陈燕铭/何学敏课题组发布关于GLP-1RA治疗糖尿病视网膜病变安全有效新机制的研究成果
稿件来源:中山大学 编辑:卢旖维 审核:孙耀斌
中大新闻网讯(通讯员何学敏、文思颖、唐喜香)糖尿病视网膜病变(DR)是糖尿病的重要微血管并发症,也是首要致盲性眼病,全球发病率高达22.27%。目前的治疗手段主要针对DR中晚期,临床上尚无有效的药物用于长期预防和早期治疗。胰高血糖素样肽-1受体激动剂(GLP-1 RAs)是近年来治疗糖尿病的“明星”药物,但对于DR患者应用GLP-1 RAs这类药物尚存在很大争议。
附属第三医院陈燕铭教授联合深圳市眼科医院张少冲课题组通过翔实数据,从临床及模型动物、细胞实验等不同角度明确证实了DR患者应用GLP-1 RAs的有效性及安全性。该研究结果近期以封面文章形式发表在国际知名期刊Acta Pharmaceutica Sinica B(中科院1区,IF:14.5)。
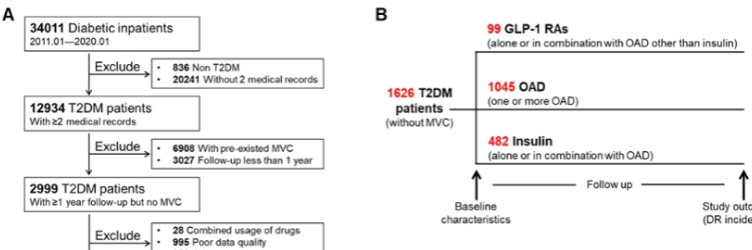
通过对2011年至2020年在附属第三医院住院的34011例2型糖尿病患者进行回顾性分析发现,相较于使用其他口服降糖药或联合使用胰岛素,使用GLP-1 RAs能显著降低DR发生率,为DR早期防治提供新的临床证据。
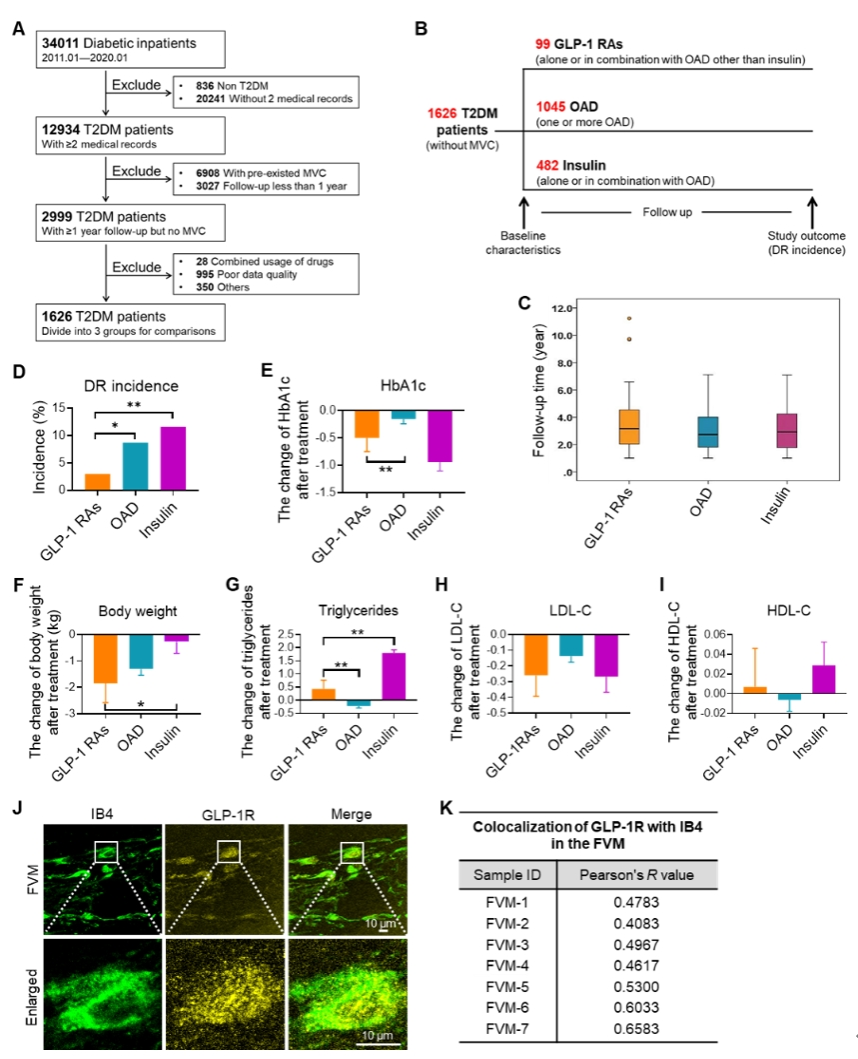
图1. 使用GLP-1 RAs降低2型糖尿病患者的DR发生率
研究团队还进一步深入探讨了GLP-1 RAs对DR血管内皮细胞影响的具体分子机制。首先,通过生信分析和染色证实,GLP-1 RAs在视网膜血管内皮中富集。
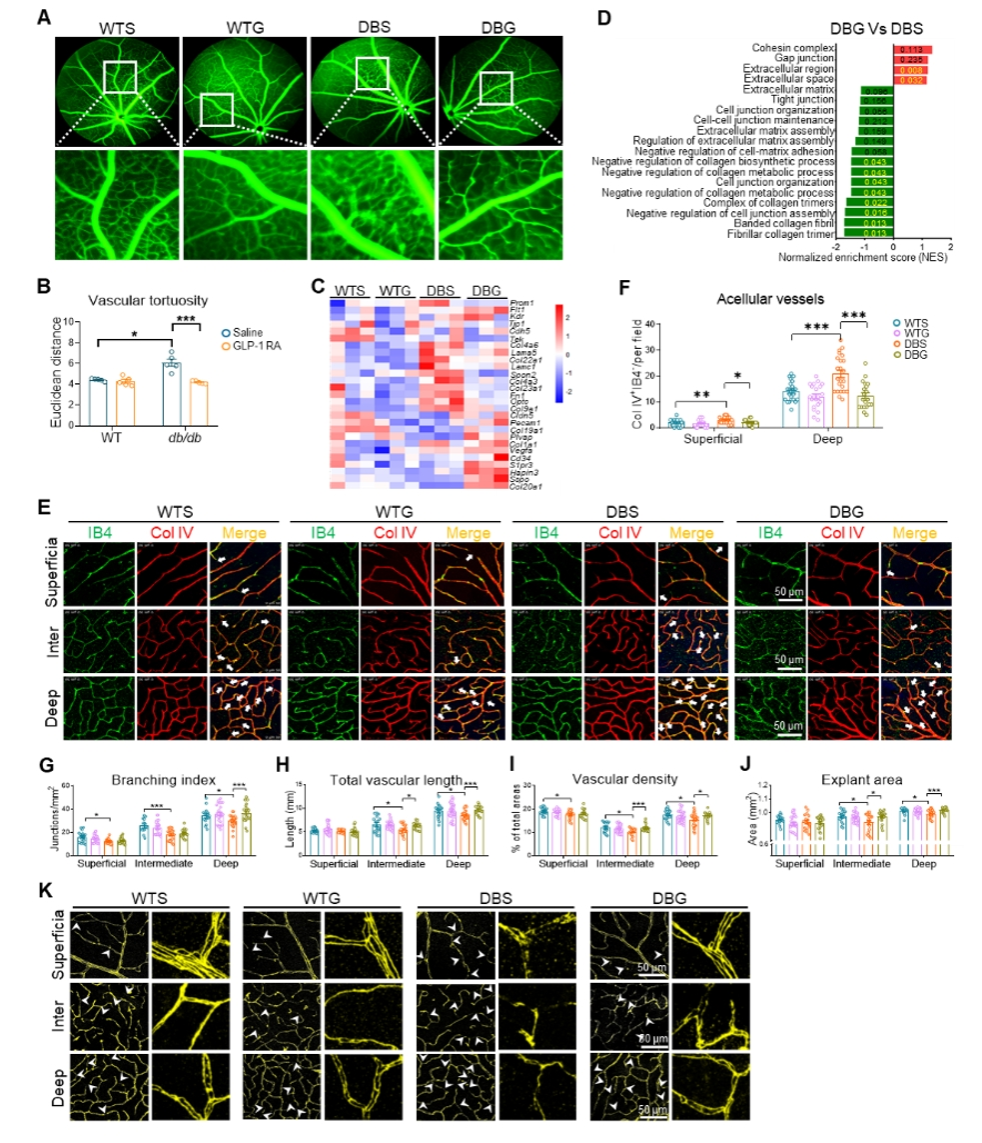
图2. GLP-1 RAs改善糖尿病视网膜血管卷曲度和紧密连接
为进一步明确GLP-1 RAs对DR的影响,使用两种GLP-1 RAs在db/db小鼠和对照组小鼠中连续腹腔给药10周。结果显示,两种GLP-1 RAs均能显著增强糖尿病小鼠的视神经电生理活动,抑制Muller细胞和astrocyte细胞的炎症反应,增加视网膜厚度,并抑制视神经节细胞丢失。通过活体眼底荧光素造影、RNA测序和免疫荧光染色证实,GLP-1 RAs确实改善血管的形态和结构。
生信分析显示,GLP-1 RAs改变了糖尿病小鼠线粒体基因富集情况。细胞实验检测线粒体膜电位和线粒体完整性发现,GLP-1 RAs(Ex-4)显著改善高脂引起的线粒体膜电位下降,并减少了线粒体DNA泄露到胞浆。对人视网膜增殖膜(FVM)和增殖性小鼠视网膜的单细胞测序数据库分析发现,STING主要富集在增殖性的内皮细胞中。
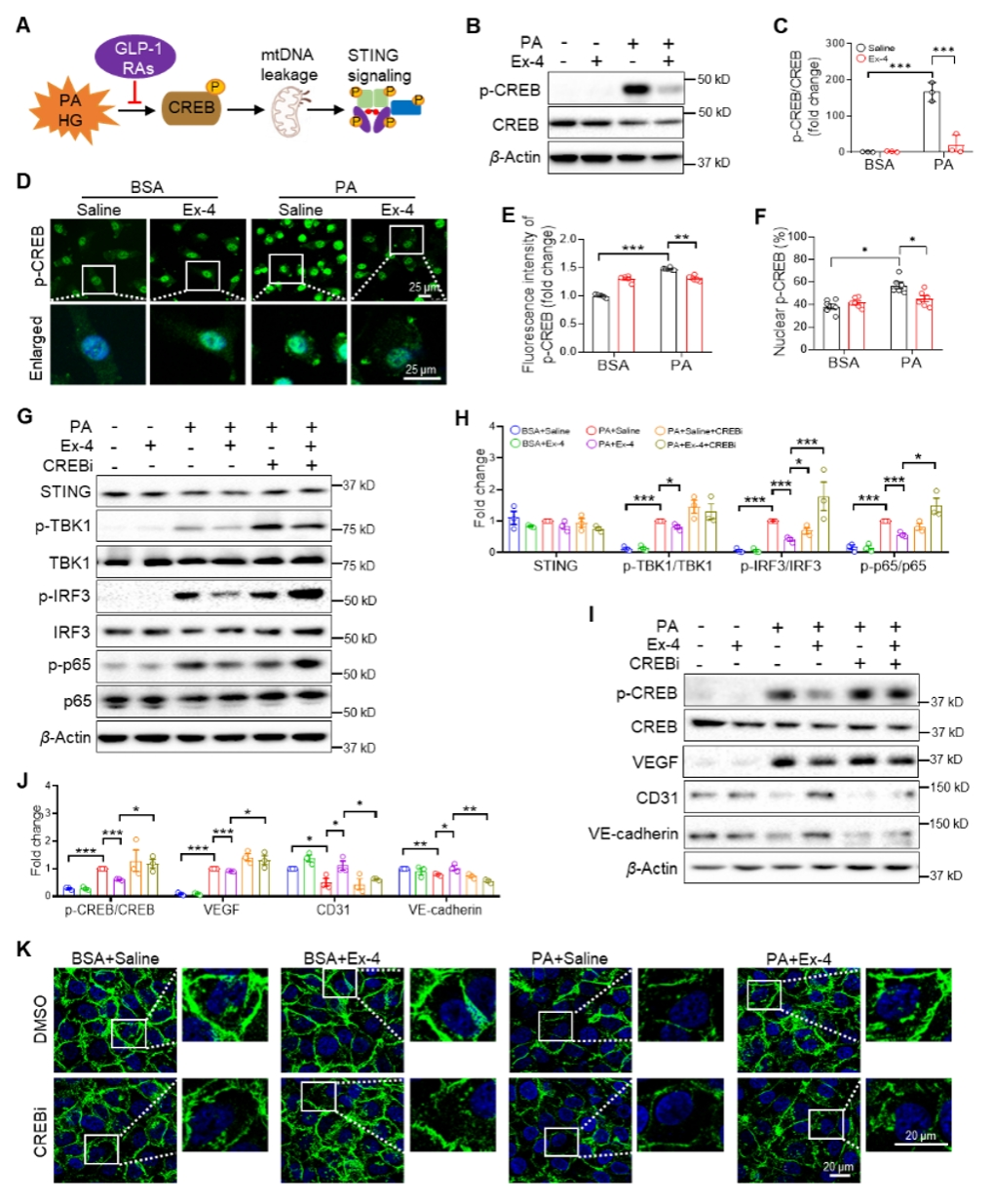
图3. GLP-1 RA通过 CREB抑制糖尿病视网膜血管的STING通路激活
RNA测序结果显示,STING通路被GLP-1 RAs显著抑制;荧光染色检测STING通路激活组分p-TBK1或STING的结果显示,腹腔或玻璃体腔注射GLP-1 RAs均可以抑制DR血管的STING通路激活;细胞实验也证实了GLP-1 RAs对高脂诱导的STING通路的抑制作用。研究进一步发现,CREB可能介导GLP-1 RAs对STING通路的调控作用。使用CREB抑制剂(CREBi)后,GLP-1 RAs对STING通路的抑制效果被阻断,伴随着内皮细胞紧密连接的保护作用也消失。
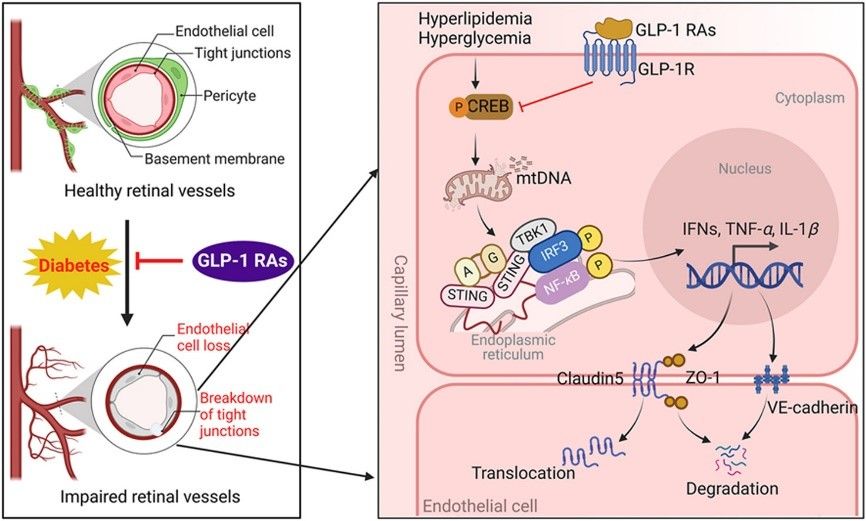
图4. GLP-1 RAs改善DR视网膜内皮炎症和血管功能障碍机制示意图
本研究率先报道了GLP-1 RAs通过抑制STING通路引起的炎症反应,保护血管内皮紧密连接减少渗漏,为GLP-1 RAs在糖尿病微血管性并发症的临床应用,提供了安全有效的重要证据。
附属第三医院内分泌科何学敏助理研究员、文思颖博士、唐喜香副主任医师为该论文共同第一作者,陈燕铭、石国军及深圳市眼科医院张少冲教授为论文共同通讯作者。该研究同时也得到附属第三医院实验医学部韩晓燕主任、丘秀生、梁淑珍等大力帮助。
论文链接:https://www.sciencedirect.com/science/article/pii/S2211383524000911
-
 孔泰霖
孔泰霖孔泰霖,男,港籍,师从亚洲鼻王郑东学教授、亚洲眼王曹仁昌教授,韩国“延世派”整形流派宗师的亲传弟子,任韩国现代美学整形医院、曼谷LBC整形医院、韩国MK公司特聘医师。曾服务于韩国bio,韩国bk整形博物馆,中国美莱整形医院。2010年从事医学诊疗工作,具备了极佳的全面医学知识结构,稳定的心理特性,优秀的身体协调性,明确的层次逻辑感,准确的团队交流能力,多向系统控制和多维影像思考能力。多年的从业沉淀,能够迅速判断求美者的治疗方案,通过娴熟的外科手法及灵活运用,赋之优秀的审美基础,打造出了一例例有口皆碑的案例。
-
 杨永利
杨永利杨永利,西安交通大学生命科学与技术学院,生物医学工程专业在读博士。现任陕西中科通大生命科学技术有限公司首席技术官,中科优脑(陕西)医疗科技有限公司法人兼股东,中国细胞生物学学会、陕西省细胞生物学学会委员。从事再生医学相关科研工作十余年,专注于再生医学领域科研成果转化及专业学术支持。
-
 黄培卿(中医)
黄培卿(中医)黄培卿,中医医师,1956年7月28日出生于山东省临沂市河东区中医世家,1992年12月毕业于山东中医大学。国家执业中医师,全科执业医师,国家执业中药师。
-
 邹殿序(中医医师)
邹殿序(中医医师)邹殿序,中医医师,就职于天津西青尚德中医门诊部。自幼随祖父学习中医,擅长运用岐黄脉法,辨证论治。尤其擅长脾胃病,痛风,皮肤病,心脏病,失眠,痛经和各种肿瘤结节性疾病的调理。
-
 由梓慧(模特、演员)
由梓慧(模特、演员)由梓慧(yota),模特、中国内地女演员,1998年7月4日出生于辽宁省大连市,毕业于上海戏剧学院表演专业。曾参演《情人节的晚餐》《艺术家》《如果我不是我》《凤汐云锦》等多部影视剧作品。
-
 徐灵真
徐灵真徐灵真,作家,道士,合香非遗传承人,民俗文化研究员,道教文化研究员。原名徐健军,法名,徐大军/徐敏灵,道号无为子,出生于辽宁省本溪市,祖籍山东日照。本师静虚子,为静虚子道长的关门弟子。后又尊本师意,先后师从龙虎山邱裕松道长,茅山杨世华道长。
-
 张宛彤
张宛彤张宛彤,女,汉族,学科记忆法高级讲师,当代新生高级家庭教育指导师,青少年儿童心理健康指导师,书君文化教育创始人,育钦学社联合创始人。
-
 何利均
何利均何利均,男,汉族,1960年5月14日出生于四川省泸州市。“天使草”品牌和“自然疗法”创始人,现任四川省中科中制医学研究院.院长。何利均投入巨资,致力于中医中药的研究30余年,以“守正创新”为科研宗旨,积极传承中华五千年的中医药文化。他提出以“养”为核心的理念,力求以“简单、轻松、愉快、显效”的方式普惠众生。